Авиатор — это азартная игра нового поколения, в которой ваша ставка может увеличиться в 100 раз за считанные минуты. От игрока требуется только наблюдать за самолетом и вовремя нажать кнопку вывода выигрыша. Заканчивать раунд при множителе х2 или ждать более высокого коэффициента - все зависит только от вашего стиля игры.
Главная задача игры Авиатор - не поддаться чувству азарта. Если вы будете ждать слишком долго, самолет улетит, и ставка будет потеряна. Грамотно рассчитывая время вывода денег и пользуясь функционалом игры, вы будете регулярно побеждать в Авиатор онлайн.
В слоте поддерживается технология “Provably Fair”, которая исключает внешнее влияние на результат. Вы всегда можете быть уверены в честности игры.
Основная информация об игре Авиатор
| ⚡Провайдер | Спрайб |
| ✔️Дата выпуска | 2019 |
| 📉 Мин. делать ставку | 0,10$ |
| 📈 Макс. делать ставку | 100$ |
| 🎁RTP | 97,30% |
| 💎Волатильность | Средний |
| 💻 Устройства | Мобильный\Компьютер |
| 🎰Демо версия | Да |
Как начать игру Авиатор
- Для начала вам необходимо выбрать одно из Aviator KZ онлайн-казино на нашем сайте.
- Пройдите процесс регистрации и внесите первый депозит.
- После этого вы сможете играть в Авиатор на реальные деньги.
Подробнее о том, как начать играть в Авиатор - у нас есть детальные инструкции для каждого отдельного казино Казахстана:
- Мостбет казино Авиатор игра как играть
- Игра Пинап Казино Авиатор как играть
- 1xBet казино Авиатор как играть
- 1Win Aviator как играть
- Казино Олимп Авиатор как играть
Об Авиаторе
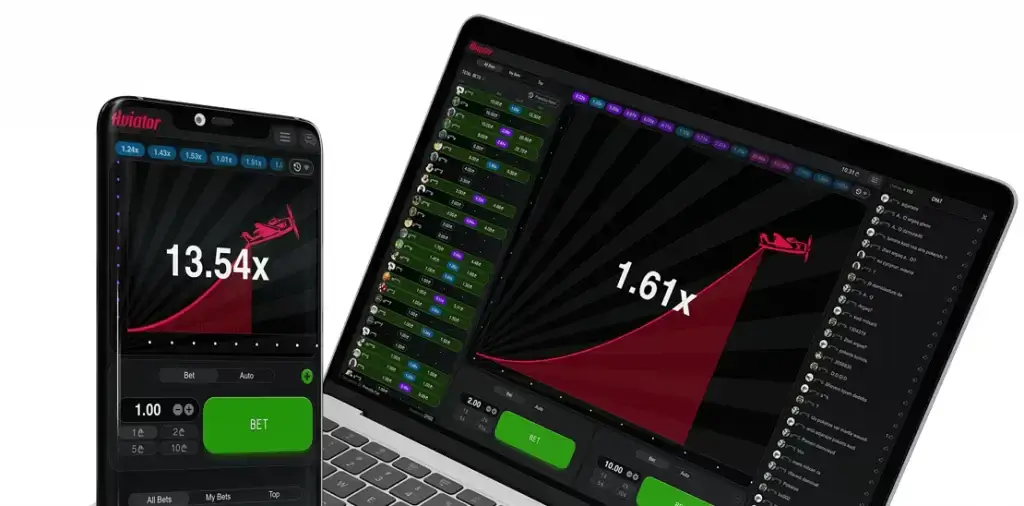
Игра Авиатор позволяет ощутить себя высококлассным пилотом. Ваша прибыль зависит от того, насколько далеко улетит самолет. Ставка умножается на коэффициент, увеличивающийся с каждой секундой.
Цель игрока - остановить раунд (вывести деньги) до того, как самолет улетит. Для этого необходимо нажать кнопку “Обналичить” под основным игровым экраном.
Долгое ожидание сопряжено с риском, ведь самолет может покинуть пределы экрана в любой момент. Однако если вы сделаете двойную ставку и настроите автоматический вывод выигрыше, шансы неудачи будут минимальными.
Что важно знать
- Множитель изначально установлен на x1, но он начинает увеличиваться после взлета самолета.
- Ваша прибыль прямо пропорциональна множителю и сумме вашей ставки.
- Перед каждым раундом коэффициент набора высоты самолета определяется генератором случайных чисел, используемым для генерации коэффициента набора высоты самолета. Вы можете использовать игровые функции, чтобы проверить честность каждого раунда.
Алгоритм игры Авиатор от Spribe
Геймплей Авиатор КЗ очень прост. Вы получаете повышение каждый раунд. ИИ следит за тем, чтобы множитель рос случайным образом. Для тех, кто не платит бетторам вовремя, множитель перестанет случайным образом расти.
Поскольку используется технология Provably FAIR, 100% гарантирует целостность и невмешательство в результаты игры со стороны Авиатор игры от Spribe в онлайн-казино Казахстана. Результат каждого раунда публикуется на серверах виртуального казино. Игроки, участвующие в раунде, способствуют его полной открытости. Кроме того, каждый может проверить и подтвердить честность игры.
Как начать играть в Авиатор?
Ставки и выплаты
- Выберите сумму ставки и нажмите кнопку «Ставка».
- Добавив вторую панель ставок, вы можете делать две ставки рядом. Чтобы добавить вторую панель стекирования, щелкните знак «плюс» в правом верхнем углу текущей панели.
- Нажмите «Выход», чтобы завершить ставку и получить свой выигрыш. Нажмите кнопку «Снять наличные», чтобы вывести деньги. Общая сумма ставки умножается на коэффициент выплаты, чтобы вы могли получить свой приз.
Автоигра и автокэш
- Флажок «Автоматическая ставка» в основной строке панели ставок активирует функцию «Автоматическая игра». Ставки размещаются автоматически после активации, но вы должны нажимать кнопку Escape в каждом раунде, чтобы обналичить деньги. Вы также можете использовать функцию автоматической проверки.
- Опцию автоматического перевода можно найти в меню «Авто» на панели ставок. Как только ваше предложение достигнет указанного вами соотношения, оно будет отправлено немедленно.
Пополнение счета и техническая поддержка в онлайн-казино
Вопросы и проблемы, возникающие в игре, оперативно решаются службой поддержки. Помощь специалиста доступна 24/7.
Большинство казино поддерживают пополнение депозита банковскими картами VISA и Mastercard. Более быстрые финансовые транзакции обеспечивают электронные платежные системы. На некоторых платформах поддерживаются денежные переводы через WebMoney, QIWI, Яндекс (UMoney).
Для вывода средств можно использовать те же платежные системы, что и для пополнения баланса. Казино позволяют переводить выигрыши на банковские карты, электронные кошельки и даже в виде криптовалюты.
Деньги обычно поступают на счет в течение нескольких минут. Для выведения выигрышей может потребоваться больше времени. Казино обычно обеспечивают денежный перевод в течение суток.
Стратегии игры
Стратегия Авиатор Х
Сложный, но очень успешный метод Авиатор.
- Мы изучаем историю шансов, чтобы увидеть, сколько раундов назад были полеты 15x или более.
- Мы отсчитаем 30 минут после этого полета, так как самолет взлетает перед большим X каждые 30 минут.
- Мы начинаем обе ставки немедленно, когда самолет проходит 5X, и заканчиваем, когда достигается 15 или более X.
С первой ставкой мы держим баланс на одном уровне, а со второй ставкой у нас есть шанс выиграть по-крупному.
На первую ставку нужно поставить до 2000 рублей, на вторую до 4000 рублей!
Стратегия удвоения Авиатора
Начинаем ставить по 200 рублей каждый. Если мы проигрываем, мы удваиваем нашу ставку; Каждый раз, когда вы закрываете ставку, мы умножаем ее на х2.
Например, если мы проигрываем, мы ставим 200 рублей; если выиграем, поставим 400 руб.
Таким образом, наша последняя ставка удваивается (потому что мы всегда закрываемся с коэффициентом 2х) и отменяет все предыдущие ставки, оставляя прибыль в размере 200 рублей на начальную ставку (200 рублей).
Вывод
Игра Авиатор предлагает не только развлечение, но и возможность заработать. Главное — стратегически подходить к ставкам и понимать, когда пора остановиться. Немного практики, и вы быстро станете мастером, успешно играя в Авиатор на официальном сайте!
Часто задаваемые вопросы
Как начать играть в Авиатор?
Авиатор онлайн игра в которую может играть каждый. Все, что вам нужно сделать, это сделать ставку и дождаться взлета самолета. Если он достигает коэффициентов по вашему выбору, вы выиграли!
Что такое технология Provably FAIR?
FAIR — это технология, обеспечивающая честную игру авиаторов. Каждый раунд оценивается игроками, участвующими в раунде, поэтому он полностью открыт. Кроме того, каждый может проверить и подтвердить честность игры.
Какие способы оплаты доступны?
Для пополнения счета вы можете использовать карты VISA или Mastercard, а в отдельных регионах - Яндекс.Деньги. Если вы не обнаружили этот метод оплаты в аккаунте, попробуйте систему WebMoney. Снятие средств возможно как на банковские карты, так и на различные электронные кошельки, включая QIWI, Яндекс.Деньги (UMoney) и прочие.
Как я могу вывести свой выигрыш?
Вы можете запросить свой выигрыш, нажав кнопку «Снять наличные». Ваш выигрыш равен ставке, умноженной на коэффициент выплат.
Что такое функция автозапуска?
Функция автоигры позволяет автоматически делать ставки. Ставки размещаются автоматически после активации функции, но вам нужно нажимать кнопку Cashout в каждом раунде, чтобы обналичить деньги.